当記事では中学理科でこれから先の3年間重要になってくる考え方、溶解度と再結晶について学びましょう。
- 再結晶とはどんなものか理解しよう。
- 再結晶を理解するために溶解度とは何か理解しよう。
もくじ
飽和水溶液と溶解度
この記事の学習のゴールである再結晶について学ぶためには、まず飽和水溶液と溶解度について学ばなければいけません。それぞれの言葉の意味は以下の通りです。
飽和水溶液…ある物質が限界まで溶けている状態の水溶液。
溶解度…水100gに物質を溶かして飽和水溶液にしたとき、とけた物質の質量。
飽和水溶液とは?
まず飽和水溶液とは、簡単に言えば「物質がそれ以上溶けなくなった水溶液」のことです。物質が限界まで溶けている状態を飽和と言いますが、「飽和した水溶液=飽和水溶液」ということですね。
例えば塩水を作るときに水に塩を加えて続けても、無限に溶けることはなくある一定の量が溶けるとそれ以上は溶けずに塩の状態のまま底に沈んでしまいます。この状態の水溶液を飽和水溶液と呼ぶわけです。
溶解度とは?
溶解度とは簡単に言えば「ある物質の水への溶けやすさ」を表す量のことで、普通は水100gに溶けている物質の質量で表されます。
物質の溶解度は物質の種類と溶ける時の水の温度によって変化します。
例えば図1に硝酸カリウム・ミョウバン・塩の溶解度と水の温度の関係をグラフにあらわしてみました(このグラフを溶解度曲線といいます。)。
硝酸カリウムとミョウバンはどちらも温度が上がれば上がるほど溶解度が高くなっています。また、60℃付近までは硝酸カリウムの方がミョウバンよりも溶解度が高いため、より多くの量が水に溶けることが分かりますね。
一方で食塩は他2つと比べて常にグラフは横ばい状態で、温度が上がっても溶解度は大きく変化していないことがわかりますね。
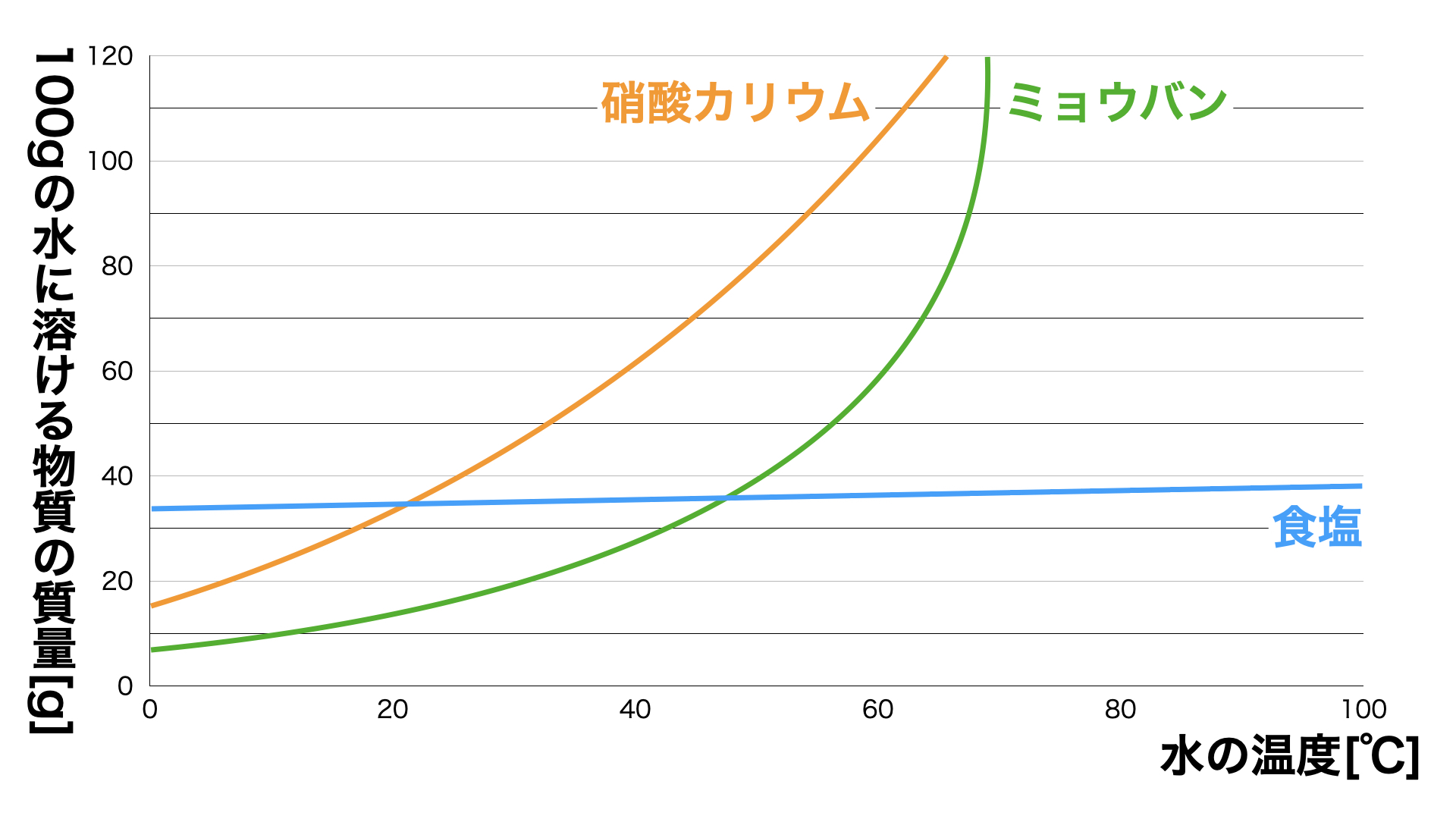
図1:溶解度曲線
再結晶とは?
ではこの記事の学習のゴールである再結晶について学びましょう。再結晶とはどのようなものでしょうか?
再結晶させる方法①:水溶液を冷やす
再結晶させる方法の1つ目が「水溶液を冷やす」方法です。
基本的に多くの物質は温度が高ければ高いほど溶解度が高くなります。温度が高くたくさん物質が溶けている状態から水溶液を冷やしていくと、溶解度が下がり物質が水に溶ける量がへるため、溶けきれなくなった物質が結晶として出てきます(図2)。
ただし食塩のような温度によって溶解度がほとんど変化しない物質の場合、この方法で結晶を取り出すことはできません。
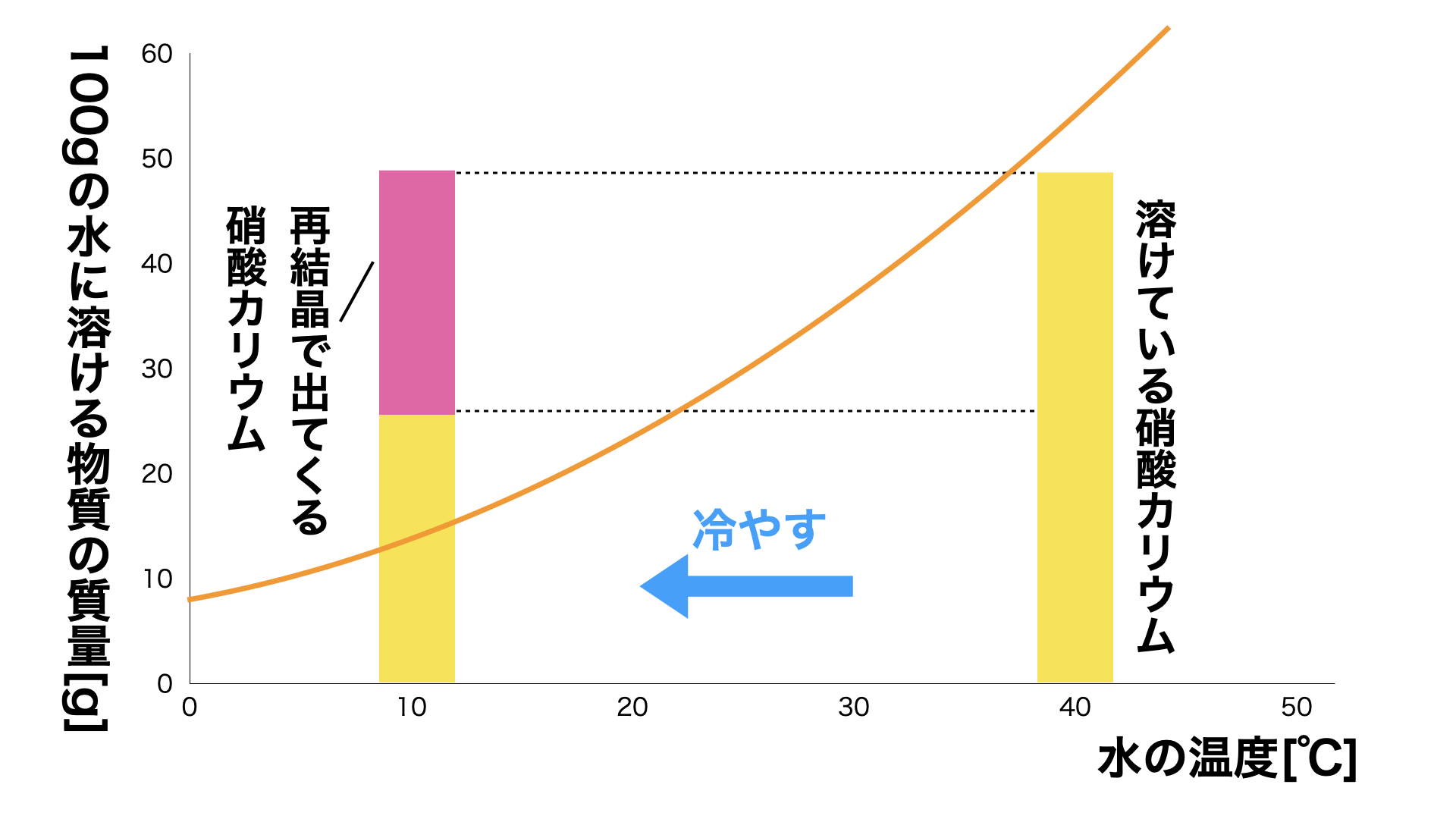
図2:再結晶のしくみ
再結晶させる方法②:水溶液の水を蒸発させる
2つ目の方法が「水を蒸発させる」方法です。
100gあたりの水に溶けることのできる物質の量はきまっており(溶解度のこと)、水が蒸発すれば溶けることのできる物質の量がへるため、溶けきれなかった物質が結晶として出てきます。
食塩のような温度によって溶解度がほとんど変化しない物質の結晶は、この方法を使って取り出します。
おまけ:結晶の形のちがい
いくつかの平面で囲まれた規則正しい形をした個体を結晶といいます。
結晶は純粋な物質で、その形や色が物質によって決まっています。中学でならう代表的な結晶を図2にまとめておきました。結晶の形が問われる問題もあるので、それぞれの形のちがいは覚えておくと良いですね。
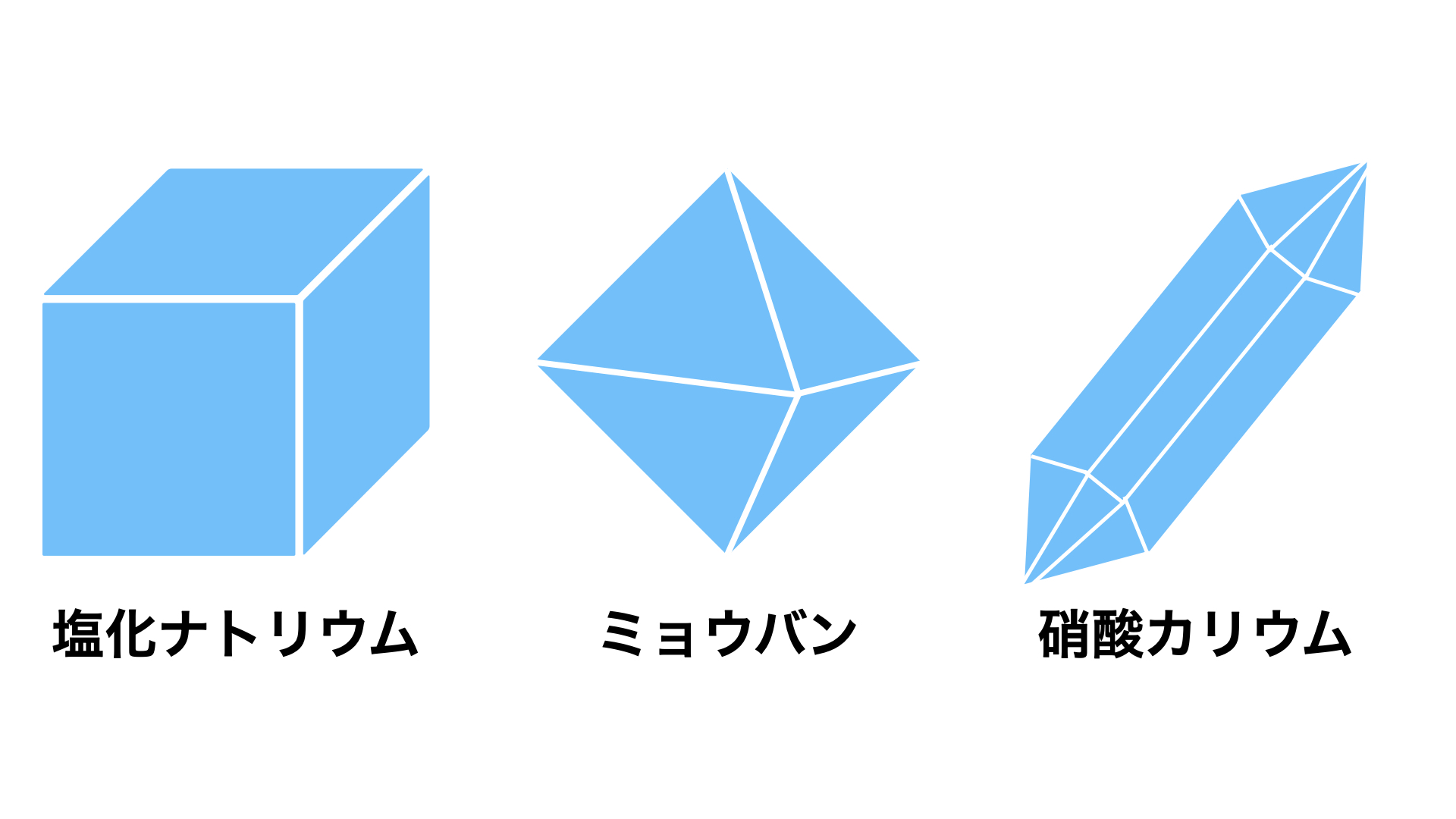
図3:結晶のちがい
まとめ
溶解度と再結晶は高校受験でもよく取り扱うテーマです。ぜひこの記事を何度も読んで内容をおぼえることをお勧めします。



コメントを残す